药品注册检验
药品审评中心(CDE)组织制定公布:药品注册检验启动的原则、程序、时限等要求
中检院制定公布:药品注册申请受理前提出药品注册检验的具体工作程序和要求以及药品注册检验技术要求和规范
-
标准复核,是指对申请人申报药品标准中设定项目的科学性、检验方法的可行性、质控指标的合理性等进行的实验室评估。-与国家药品标准收载的同品种药品使用的检验项目和检验方法一致的,可以不进行标准复核,只进行样品检验。
-
样品检验,是指按照申请人申报或者药品审评中心核定的药品质量标准对样品进行的实验室检验。
-
前置注册检验:药品上市许可申请受理前,申请人提出的药品注册检验。
-
上市申请审评中注册检验:药品审评中心基于风险启动的质量标准部分项目复核和现场核查的抽样检验,以及因申报资料真实性存疑或投诉举报等基于审评需要启动的有因抽样检验。
-
上市申请受理时注册检验:在上市许可申请受理后40个工作日内由药品审评中心启动的药品注册检验。
-
上市批准后补充申请注册检验:上市批准后补充申请审评过程中,药品审评中心于申请受理后40个工作日内基于风险启动的注册检验。
-
中检院:中检院承担境内外生产的创新药、改良型新药(中药除外)、生物制品、按照药品管理的体外诊断试剂的注册检验工作;负责组织口岸药品检验机构开展需由其承担的境外生产药品的注册检验。
-
省所:省级药品检验机构,承担辖区内除中检院和口岸药品检验机构职责外的药品注册检验工作。
-
指定机构:中检院或国家药品监督管理局指定的药品检验机构承担放射性药品和国家药品监督管理局规定的其他药品的注册检验工作。
-
口岸:口岸药品检验机构,按要求参加中检院组织的境外生产药品的注册检验工作。
01准备申请(省所要求不同)02提出申请03接受审核04注册检验与报告发送
时限:
-
启动-受理后40日内
-
药品审评中心启动的注册检验,申请人应当在30个工作日内,向省级药品监督管理部门申请完成抽样并向药品检验机构送样。现场核查抽样检验应在抽样后10个工作日内向药品检验机构送样
-
资料和样品接收审核5个工作日。样品检验60个工作日,样品检验和标准复核90个工作日。药品注册检验过程中补充资料时限30个工作日
-
需要药品检验机构提交注册检验报告的,药品审评中心应当在审评时限届满40个工作日前告知。药品检验机构按要求应当配合药品审评中心,通过“数据共享平台”推送注册检验报告。
注册现场核查法规
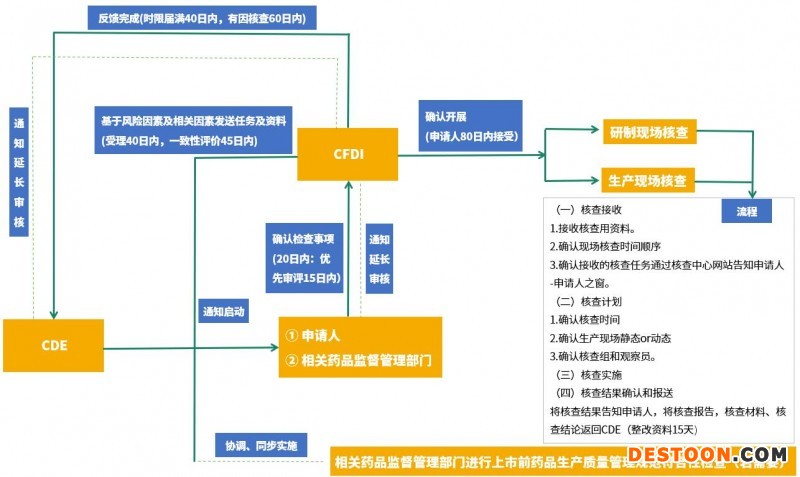
药品注册申请受理后,药品审评中心(CDE)在药品注册申请受理四十日内通知药品核查中心(CFDI)启动注册核查工作,以核实申报资料的真实性、一致性以及药品上市商业化生产条件,检查药品研制的合规性、数据可靠性等。
备注:
-
核查过程中认为有必要进行样品检验的,所抽取的样品应在核查结束之日起10日内,送达指定药品检验机构。
-
延长时限不超过原时限的二分之一。


备注:
-
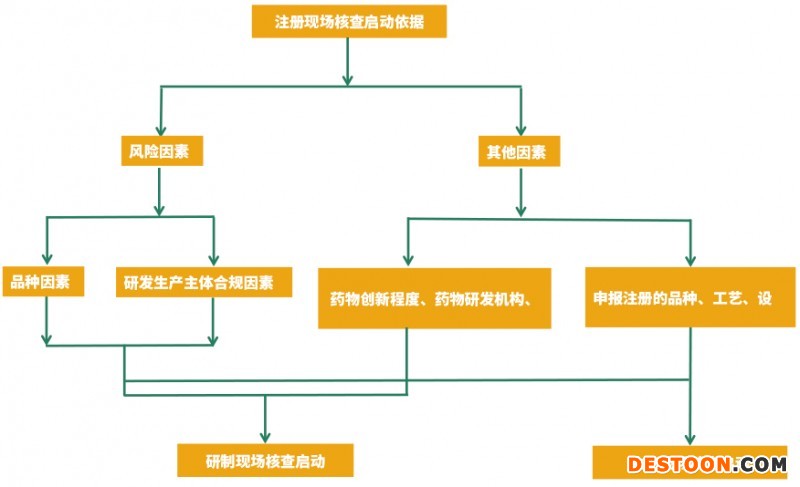
原则上以品种因素和研发生产主体合规因素中风险情形较高的确定注册申请风险等级,特殊情况的除外。对于补充申请,生物制品和中药注射剂不纳入品种因素高风险情形。
-
药品研制基本情况(如属委托,应说明被委托研究单位基本情况)。
-
研制所涉及的批次(含BE批)批量用途,研制批次(含BE批)生产的地址、生产线、时间地点、使用量和剩余量等。
-
研制批次(含BE批)所用处方生产工艺、原辅料包装材料来源及标准、生产线(设备设施)、产品质量标准(含中间控制标准)等是否与已上市/拟上市商业化生产规模的批次一致。
-
参比制剂的来源、采购和使用情况。
-
药品和参比制剂体外研究的对比研究情况,研究时间、批号和研究结果。(质量对比和溶出曲线)
-
药品关键质量属性(含稳定性)研究情况。(全检数据及稳定性数据)
-
接受现场检查品种全套注册申报资料。
-
委托研究协议和质量协议,如有。
-
参比制剂的来源及证明,如购买发票、赠送证明等。参比制剂的包装标签、说明书、剩余样品等。参比制剂的接收、发放、使用记录或凭证。
-
药品相关研究记录,包括:处方工艺研究原始记录,如有;样品试制相关原始记录;质量研究相关原始记录;体外评价及稳定性研究的相关原始记录;仪器设备使用记录;纸质图谱及电子图谱。
-
其他相关文件,包括:处药品检验方法确认或验证资料;稳定性试验方案及报告;体外研究总结报告;溶出度仪的验证资料;研究用的剩余样品情况(不应销毁)。
-
组织机构与人员:研究内容相适应的管理机构,相应的质量管理;具有资质的人员
-
研究条件:场地、设备、仪器和管理制度
-
文件和记录:应当建立文件和记录管理的制度或标准操作规程。药物研究开发全过程应有相应记录,包括预试验和探索性研究的数据和记录
-
变更和偏差管理:至少在药物进入临床阶段后就应当建立与药物研发阶段相适应的变更、偏差和失败管理制度或标准操作规程,针对关键批次出现的偏差或失败应当得到适当的调查和/或分析,并进行记录
-
委托机构:
➢ 委托其他机构进行全部或部分药学研究及样品试制的,委托方应当对受托方的研究能力、质量管理体系等进行评估,以确证其研究条件和研究情况
➢ 双方应当签订委托合同或其他有效证明
➢ 委托方应当对委托研究的过程和结果负责,并确保委托研究过程中的数据可靠性。受托方应当遵守相关要求,保证研究及样品制备过程规范、数据真实可靠、研制过程可追溯
-
发现真实性问题或申报资料真实性存疑,申请人不能证明其真实性的;
-
关键研究活动、数据缺少原始记录导致无法溯源的;
-
发现与申报资料不一致,可能影响质量评价的;
-
存在严重的数据可靠性问题,导致对药品安全性、有效性、质量可控性的评价产生影响的;
-
拒绝、不配合核查,导致无法继续进行现场核查的。
参考文献:
1.《药品注册管理办法》(2020年27号)-第四、五节
2.《药品注册检验工作程序和技术要求规范(试行)》(2020年7月)
3.《药品质量抽查检验管理办法》(国药监药管〔2019〕34号)及药品抽样原则及程序(征求意见稿)
4.《药品注册核查检验启动原则和程序管理规定(试行)》(征求意见稿)及起草说明 (2020年4月)
5.《药品注册核查实施原则和程序管理规定(征求意见稿)》及起草说明(2020年5月)
6.《药品注册核查要点与判定原则(征求意见稿)》及起草说明(临床、非临床、研制和生产现场) (2020年5月)
7.《仿制药质量和疗效一致性评价现场核查指导原则》(临床试验数据、研制现场核查、生产现场核查、有因核查)( 2017年第77号)
8.企业指南(草案):《仿制药质量和疗效一致性评价现场检查要求》(研制现场、生产现场)(2018年4月)
9.《药品注册现场核查管理规定》(国食药监注[2008]255号)
10.《药品检查管理办法(试行)》(国药监药管〔2021〕31号)
11.《药品生产现场检查风险评定指导原则》(食药监药化监〔2014〕53号)
-END-
关于我们:
北京新领先成立于 2005 年,注册资金近亿元,于 2015 年实现上交所上市(股票代码:600222),是一家面向全球提供药学临床前研究、临床 CRO 和CDMO服务的高新技术企业,连续多年蝉联“中国医药研发公司榜首”。
目前,公司已与国内外上下游500余家企业建立合作关系,其中部分企业为战略合作关系。累计承接了药学研发项目400余项、临床研究项目500余项,申请专利200余项,获得授权近百项。
公司从建立伊始就以“是我,让中国新药技术和生产工艺与世界同步”作为企业愿景,致力于用创新的研发和服务模式以及信息化技术推动中国医药产业发展,缩小与世界先进水平间的差距,让中国人民早日用上安全药和良心药!
公司总部位于北京中关村高新技术园区,拥有 10000 平米研发实验室,同时在郑州临空生物园区建立了新药筛选及检测平台、药物评价平台(动物房,GLP、AAALAC、CNAS 认证)、大分子中试及大规模生产服务平台、小分子 CMC 制剂研究生产平台、细胞技术服务平台和临床 CRO 平台等六大符合国际标准(FDA、EMA 和 NMPA GMP 标准)的研发平台,形成“新领先 CXO”全产业链服务体系。仿创结合,双引擎驱动,能够为客户提供药学研发全生命周期的多元化服务。




